Jeśli potrzebujecie Państwo pomiarów składu gazu w procesie konwersji SO2 do SO3, chętnie podejmiemy się takiego wyzwania. Także nasze laboratorium może zbadać stosowany katalizator wanadowy i na podstawie zawartości substancji aktywnych, możemy ocenić stopień jego degradacji.
Poniżej opisaliśmy dlaczego kontrolowanie temperatury w procesie chemicznym (konwersji SO2 do SO3) jest tak bardzo ważne w kontekście efektywności procesu.
Proces konwersji dwutlenku siarki (SO2) do trójtlenku siarki (SO3) jest kluczowy w przemyśle chemicznym, szczególnie w produkcji kwasu siarkowego. Co więcej, używany jest również do produkcji innych związków organicznych wytwarzanych w procesie sulfonowania. Substancje te stosowane są m.in. w przemyśle kosmetycznym i farmaceutycznym. Bardzo popularne w tej kategorii są związki pianotwórcze i myjące – powszechnie stosowane w szamponach, zwane SLS oraz SLES, tj. laurylosiarczan sodu oraz etoksylowany laurylosiarczan sodu.
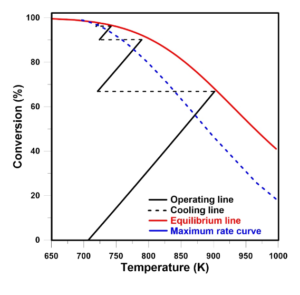 Pomimo istotności procesu produkcji SO3, jego praktyczna realizacja wiąże się z pewnymi trudnościami. Konwersja SO2 do SO3 jest procesem egzotermicznym, co oznacza, że w reakcji wydziela się ciepło. Niska temperatura sprzyja wysokiej konwersji, która jest pożądana, lecz aby proces zachodził w sposób szybki (kinetyka reakcji) i skuteczny, niezbędna jest odpowiednio wysoka temperatura (około 450°C) do pracy katalizatora. Jako katalizator stosuje się przede wszystkim pięciotlenek wanadu (V2O5) osadzony na nośniku krzemionkowym. Niemniej jednak, zbyt wysoka temperatura (>620°C) może spowodować uszkodzenie katalizatora i pogorszenie skuteczności całego procesu konwersji.
Pomimo istotności procesu produkcji SO3, jego praktyczna realizacja wiąże się z pewnymi trudnościami. Konwersja SO2 do SO3 jest procesem egzotermicznym, co oznacza, że w reakcji wydziela się ciepło. Niska temperatura sprzyja wysokiej konwersji, która jest pożądana, lecz aby proces zachodził w sposób szybki (kinetyka reakcji) i skuteczny, niezbędna jest odpowiednio wysoka temperatura (około 450°C) do pracy katalizatora. Jako katalizator stosuje się przede wszystkim pięciotlenek wanadu (V2O5) osadzony na nośniku krzemionkowym. Niemniej jednak, zbyt wysoka temperatura (>620°C) może spowodować uszkodzenie katalizatora i pogorszenie skuteczności całego procesu konwersji.
Chcąc uzyskać jak najwięcej SO3, dąży się do uzyskania równowagi chemicznej. W tym celu stosuje się aparaty wyposażone w kilka półek wypełnionych katalizatorem. I jak wspomniano wyżej, niższa temperatura sprzyja wyższym stopniom konwersji. Na półkach katalizatora temperatura rośnie wskutek reakcji, dlatego też stosuje się chłodzenie gazu między półkami, aby nie doprowadzić do zniszczenia katalizatora. W przeciwieństwie do równowagi reakcji, wzrost temperatury sprzyja lepszej kinetyce reakcji. Im lepsza kinetyka, tym reakcja konwersji zachodzi szybciej. Sposób ten umożliwia w porównywalnym czasie produkować więcej SO3. Dlatego też, wskazana jest kontrola temperatury w celu prowadzenia procesu w sposób efektywny.
Warto również zwrócić uwagę na fakt, iż temperatura, równowaga i kinetyka mocno zależą od składu gazu, tj. zawartości SO2, SO3 i O2. Dlatego podczas prowadzenia procesu tak ważny jest pomiar i kontrola całego procesu konwersji. Dzięki m.in. pomiarom SO2 wzdłuż całej kolumny konwersji można określić efektywność całego procesu.
Zapraszamy do współpracy!
Przygotował: Tomasz Spietz
Zakład Transformacji Energetycznej